
Raportul anual al EMA pentru 2024 oferă informații despre prioritățile strategice ale Agenției și contribuțiile sale la sănătatea publică și veterinară în Uniunea Europeană (UE).
În anul care a trecut am avut 114 medicamente noi care au fost autorizate pentru piața europeană, 46 dintre acestea conținând substanțe active inovatoare. Și în domeniul veterinar am avut cel mai mare număr de recomandări pentru autorizare de până acum (25 medicamente noi).
Raportul digital prezintă cele mai importante aspecte legate de evaluarea și monitorizarea medicamentelor umane și veterinare, precum și o selecție de date-cheie. Raportul este completat de o cronologie interactivă a principalelor realizări din 2024, cu funcționalități avansate care permite cititorilor să exploreze fiecare subiect mai în detaliu, accesând documente suplimentare, materiale audio-vizuale și infografice.
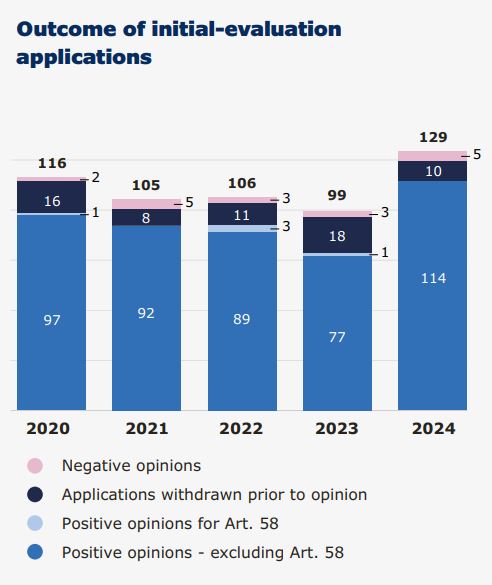 În 2024, EMA a recomandat 114 medicamente pentru autorizare de punere pe piață. Dintre acestea, 46 conțineau o substanță activă nouă, care nu fusese autorizată anterior în UE. Printre acestea se află mai multe medicamente remarcabile prin contribuția lor la nevoile de sănătate publică sau prin inovațiile pe care le reprezintă. 5 aplicații au primit opinie negativă în 2025 și alte 8 solicitări de autorizare au fost retrase de către companii, înainte ca CHMP să se pronunțe.
În 2024, EMA a recomandat 114 medicamente pentru autorizare de punere pe piață. Dintre acestea, 46 conțineau o substanță activă nouă, care nu fusese autorizată anterior în UE. Printre acestea se află mai multe medicamente remarcabile prin contribuția lor la nevoile de sănătate publică sau prin inovațiile pe care le reprezintă. 5 aplicații au primit opinie negativă în 2025 și alte 8 solicitări de autorizare au fost retrase de către companii, înainte ca CHMP să se pronunțe.
În domeniul veterinar, EMA a recomandat 25 de medicamente veterinare pentru autorizare – cel mai mare număr de recomandări într-un singur an. Dintre acestea, două conțineau o substanță activă nouă. 14 erau vaccinuri, inclusiv șapte dezvoltate printr-un proces biotehnologic.
Raportul include interviuri cu Bruno Sepodes, președintele Comitetului pentru medicamente de uz uman (CHMP) al EMA, Ulla Wändel Liminga, președinta Comitetului pentru evaluarea riscurilor în materie de farmacovigilență (PRAC) și Gerrit Johan Schefferlie, președintele Comitetului pentru medicamente veterinare (CVMP), care evidențiază principalele realizări și activități ale comitetelor lor din 2024 și conturează viziunea și prioritățile pentru anul următor.
Alte activități importante prezentate în raport includ eforturile Agenției de a investi în procese mai bune și decizii de reglementare bazate pe dovezi, prin inițiative precum:
- Accelerarea studiilor clinice în UE (ACT EU) și
- Rețeaua de analiză a datelor și interogarea datelor din lumea reală (DARWIN EU), facilitarea adoptării metodelor avansate de fabricație și utilizarea inteligenței artificiale în beneficiul pacienților și al sănătății publice, precum și
- activitatea EMA de consolidare a colaborării în rețeaua europeană de reglementare a medicamentelor și la nivel internațional.
Ca de obicei, al doilea capitol al raportului este dedicat statisticilor de bază și tendințelor care ilustrează activitatea Agenției în domeniul reglementării medicamentelor.
Raportul integral poate fi citit aici: Raportul EMA 2024
Material preluat si tradus de pe: https://www.ema.europa.eu/en/news














